ผู้ช่วยศาสตราจารย์ ดร.วรวิทย์ จันทร์สุวรรณ
ปรับปรุงล่าสุด: 23 พฤษภาคม 2563
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) : การวิเคราะห์โดยน้ำหนัก (gravimetric analysis) เป็นเทคนิคที่เกี่ยวข้องกับการวัดปริมาณสารที่สนใจโดยการชั่งน้ำหนัก จัดเป็นวิธีการวิเคราะห์ที่ง่าย แต่ต้องอาศัยเทคนิคการชั่งสารที่ถูกต้องและสารที่นำมาชั่งจะต้องมีความบริสุทธิ์สูงไม่มีสารปนเปื้อนเจือปน การวิเคราะห์โดยน้ำหนักทำได้ 2 วิธีคือ วิธีการตกตะกอน (precipitation) และวิธีการทำให้ระเหย (volatilization) วิธีการตกตะกอน นิยมใช้ในกรณีที่ธาตุหรือไอออนที่สนใจมีปริมาณค่อนข้างมาก (10-20%) หรือมีขนาด 100 mg ขึ้นไป (macro quantitative analysis) สารตัวอย่างจะถูกทำให้เกิดเป็นตะกอนที่มีความสามารถในการละลายต่ำ จากนั้นตะกอนจะถูกแยกออกจากสารละลายและถูกทำให้แห้ง ตะกอนที่ได้จะถูกชั่งน้ำหนักและถูกเปรียบเทียบน้ำหนักของสารตัวอย่างเริ่มต้น วิธีการตกตะกอนใช้วิธีการแยกเอาธาตุที่สนใจออกจากสารตัวอย่างทีละขั้นตอน แล้วเปลี่ยนให้อยู่ในรูปที่มีความบริสุทธิ์สูงสุดที่สามารถชั่งได้ (weighing form) เช่น การหาปริมาณซัลเฟอร์ (S) ในตัวอย่าง โดยการตกตะกอนในรูปแบบแบเรียมซัลเฟต (BaSO4) การวิเคราะห์ด้วยวิธีวิธีการตกตะกอนใช้เวลามาก แต่มีข้อดีคือผลการวิเคราะห์มีความแม่นสูง สามารถตรวจสอบความคลาดเคลื่อนได้ เช่น ตรวจสอบว่าตะกอนตกสมบูรณ์ การวัดสามารถทำโดยตรงโดยไม่ต้องเทียบมาตรฐาน และสามารถตรวจสอบความบริสุทธิ์ของตะกอน และใช้อุปกรณ์พื้นฐานทางเคมีทั่วไปที่มีอยู่แล้วในห้องปฏิบัติการทางเคมี ความถูกต้องของวิธีนี้จะอยู่ที่เทคนิคของการตกตะกอนและธรรมชาติของตะกอนที่เกิดขึ้นซึ่งพอจะสรุปได้ดังนี้
- สัดส่วนของการเกิดตะกอนต้องคงที่
- ตะกอนที่เกิดขึ้นมีความสามารถในการละลายต่ำในสารละลายตัวอย่างและในสารละลายหรือน้ำล้างตะกอน
- ในขั้นตอนการวิเคราะห์ตลอดจนในองค์ประกอบของตัวอย่าง ตัวรบกวนต้องมีปริมาณที่ต่ำ
- ตะกอนที่เกิดขึ้นต้องมีพื้นผิวน้อยเพื่อป้องกันการถูกปนเปื้อนบนผิวของตะกอนจากสิ่งเจือปน
- เทคนิคการแยกตะกอนออกจากสารละลายเริ่มต้นและการล้างตะกอนต้องทำอย่างระมัดระวังเพื่อป้องกันการสูญเสียตะกอนที่เกิดขึ้น
- ตะกอนที่เกิดขึ้นต้องมีความเสถียรที่อุณหภูมิสูง
- ตะกอนที่บริสุทธิ์ที่ได้จากการเผาแล้วต้องมีความสามารถในการดูดความชื้นได้ต่ำ
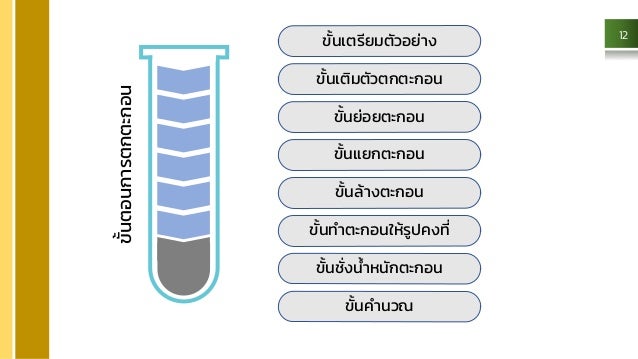
ขั้นตอนการวิเคราะห์ด้วยวิธีการตกตะกอน
ในการวิเคราะห์โดยการชั่งน้ำหนักต้องอาศัยปฏิกิริยาเคมี เพื่อเปลี่ยนองค์ประกอบให้อยู่ในรูปที่สะดวกต่อการแยกและสามารถชั่งได้อย่างถูกต้อง น้ำหนักของผลิตภัณฑ์ที่ได้จากปฏิกิริยาสามารถคำนวณย้อนกลับไปหาน้ำหนักขององค์ประกอบโดยใช้ปริมาณสารสัมพันธ์จากปฏิกิริยาที่ดุลแล้วBa2+(aq) + SO42-(aq) → BaSO4(s)
เมื่อชั่งตะกอน BaSO4 ที่เกิดขึ้น สามารถคำนวณน้ำหนักของ SO42- ในสารตัวอย่าง ได้จาก% SO42- = น้ำหนักตะกอน x gravimetric factor x 100
โดยที่ gravimetric factor (GF) คืออัตราส่วนระหว่าง น้ำหนักสูตรอนุมูลที่ต้องการกับ น้ำหนักสูตรของตะกอนบริสุทธิ์ [Link ดูรายละเอียด gravimetric factor]อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- ครูซิเบิลพร้อมฝาปิด (crucible)
- ตู้อบไฟฟ้า
- โถดูดความชื้น (decicator)
สารเคมี (Reagents) :
- สารละลายแบเรียมคลอไรด์ (BaCl2 5 % w/v)
- สารละลายซิลเวอร์ไนเทรต (AgNO3 0.10 mol/L)
- กรดไฮโดรคลอริกเข้มข้น (conc. HCl, 36%w/v)
วิธีการทดลอง (Methodology) :
- เตรียมครูซิเบิลพร้อมฝาปิด ที่มีน้ำหนักคงที่โดยการนำครูซิเบิลพร้อมฝาที่ล้างสะอาดอบที่อุณหภูมิ 105°C ประมาณ 1 ชั่วโมง ทำให้เย็นในเดซิเคเตอร์แล้วชั่งน้ำหนักที่คงที่
- ชั่งตัวอย่างให้ได้น้ำหนักที่แน่นอนในช่วง 30-0.35 กรัม ใส่สารตัวอย่างลงในบีกเกอร์ 400 mL
- เติมน้ำกลั่นลงไป 25 mL และเติม HCl ลงไป 0.5 mL (ประมาณ 10 หยด) เติมน้ำกลั่นให้ได้ปริมาตรประมาณ 200-250 mL คนให้สารละลายตัวอย่างละลายเป็นเนื้อเดียวกัน
- ต้มสารละลายให้เดือด ยกลงจาก hot plate จากนั้นเติมสารละลาย BaCl2 ปริมาตร 10-12 mL อย่างช้า ๆ พร้อมทั้งคนตลอดเวลา
- ปล่อยให้เกิดตะกอนที่ก้นบีกเกอร์ประมาณ 2-3 นาที ทดสอบว่าการตกตะกอน BaSO4 เกิดขึ้นสมบูรณ์หรือยัง โดยการหยดสารละลาย BaCl2 ลงไปบนสารละลายส่วนที่ใส ถ้าพบว่ามีตะกอนขาวขุ่น ให้เติมสารละลาย BaCl2 ลงไปอีก 3 mL และคนให้เข้ากัน ทดสอบความสมบูรณ์ของการตกตะกอนอีกครั้ง เมื่อการตกตะกอน BaSO4 เป็นไปอย่างสมบูรณ์แล้ว ให้นำสารแขวนลอยนี้ไปอุ่นให้ร้อน (อย่าให้เดือด) เป็นเวลา 1 ชั่วโมง
- กรองตะกอนที่ได้ด้วยกระดาษกรองเบอร์ 42 (ต้องฉีดล้างตะกอนที่ติดกับบีกเกอร์ออกให้หมดด้วยน้ำร้อน) จากนั้นล้างตะกอนที่ได้ด้วยน้ำร้อนหลายๆ ครั้งจนปราศจากไอออนคลอไรด์ (ทดสอบโดยสารละลาย AgNO3 ถ้ายังมีตะกอนมีขาวให้ล้างตะกอนต่อด้วยน้ำร้อน)
- นำกระดาษกรองพร้อมตะกอนออกจากกรวยกรอง พับกระดาษกรองดังรูป
- นำกรวยกระดาษกรองที่พับเสร็จแล้วใส่ลงในถ้วยครูซิเบิลที่มีฝาปิด นำไปเผาด้วยตะเกียงบุนเสน (รูปที่ 2) ค่อยๆให้ความร้อนเพื่อให้กระดาษกรองเกิดการไหม้อย่างช้า ๆ ขณะที่ทำการเผาให้เปิดฝาครูซิเบิลไว้ ถ้ากระดาษกรองติดไฟลุกไหม้ขึ้นมาให้ปิดฝาทันที เมื่อกระดาษกรองถูกเผาไหม้จนหมดแล้วให้เปลี่ยนไปเผาด้วยเตาเผาที่อุณหภูมิ 600°C เป็นเวลา 1 ชั่วโมง
- นำครูซิเบิลออกจากเตาเผาวางบนแผ่นกระเบื้องที่สะอาดจนอุณหภูมิลดลงและทิ้งให้เย็นในโถดูดความชื้น
- นำไปชั่งหาน้ำหนักที่แน่นอน
หมายเหตุ ตะกอนหลังการทดลองให้พับในกระดาษ ทิ้งในถัง ห้ามทิ้งในอ่างน้ำชั่งไฟฟ้า ความละเอียด
การทดลอง 1.2 : การหาปริมาณความชื้นในใบชา (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
ความชื้น (moisture content) คือสารที่สูญเสียไปจากตัวอย่างเมื่อเพิ่มความร้อนให้แก่ตัวอย่างนั้น ความร้อนที่ให้ต้องมีอุณหภูมิไม่สูงกว่าจุดเดือดของน้ำหรือปล่อยให้สารตัวอย่างตั้งทิ้งไว้ในสารดูดความชื้น น้ำหนักที่หายไปจากตัวอย่างคือสารที่ระเหยได้ทั้งหมด (total volatile matter) ส่วนกากหรือของแข็งแห้งที่เหลืออยู่หลังจากน้ำระเหยออกไปหมดแล้วเรียกว่า ของแข็งทั้งหมด (total solid) การวิเคราะห์หาปริมาณความชื้นที่นิยมใช้ในห้องปฏิบัติการมากคือวิธีให้ความร้อนด้วยเตาอบร้อน โดยมีหลักการคือหาน้ำหนักตัวอย่างที่หายไป เนื่องจากการระเหยของน้ำที่มีอยู่ในสารตัวอย่างเป็นไอน้ำ ที่อุณหภูมิใกล้จุดเดือดหรือที่จุดเดือดของน้ำ แต่อาจมีพวกน้ำมันระเหยที่ประกอบอยู่ในตัวอย่างสูญเสียไปด้วย เทคนิคการวิเคราะห์โดยการทําให้ระเหยมี 2 แบบ คือ
1) วิธีตรง (direct method) ใช้ตัวดูดกลืนที่เหมาะสม ซึ่งจะดูดกลืนไอสารที่ได้จากการเผาตัวอย่างน้ำหนักที่เพิ่มขึ้นของตัวดูดกลืนคือน้ำหนักของไอที่ได้
2) วิธีอ้อม (indirect method) เป็นการหาน้ำหนักที่สูญเสียไปของสารประกอบเมื่อนํามาเผา เช่น การหาปริมาณน้ำในตัวอย่าง ผลต่างของน้ำหนักของตัวอย่างก่อนเผาและหลังเผาคือปริมาณน้ำในตัวอย่าง
อุปกรณ์ (Equipments) :
- เครื่องชั่งละเอียด 4 ตำแหน่ง
- ครูซิเบิล
- ตู้อบไฟฟ้า
- โถแก้วดูดความชื้น
สารเคมี (Reagents) :
- ใบชา
วิธีการทดลอง (Methodology) :
- อบครูซิเบิลพร้อมฝาปิดที่ 105°C เป็นเวลา 30-60 นาที เก็บไว้ในโถแก้วดูดความชื้น
- ชั่งน้ำหนักครูซิเบิลพร้อมฝาปิด จดน้ำหนักที่แน่นอน
- ชั่งตัวอย่างประมาณ xxx กรัม ใส่ในครูซิเบิล จดน้ำหนักสารตัวอย่าง
- อบพร้อมฝาปิด (เปิดฝาปิดเล็กน้อย) ในตู้อบไฟฟ้าที่อุณหภูมิ 105°C เป็นเวลาประมาณ 3 ชั่วโมง
- นำครูซิเบิลพร้อมฝาปิด (อย่าใช้มือจับ) ทิ้งให้เย็นในโถดูดความชื้นประมาณ 30 นาที
- ชั่งน้ำหนัก
- นำไปอบซ้ำ ครั้งละ 30 นาที จนกระทั่งได้น้ำหนักที่คงที่
การทดลอง 2.1 : การเตรียมสารละลายและการหาความเข้มข้นแน่นอนของสารละลาย NaOH (เวลา 2 ชั่วโมง)
| จุดประสงค์ | |
|---|---|
| |
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
การหาความเข้มข้นแน่นอน (standardization) เป็นขั้นตอนการหาความเข้มข้นแน่นอนของสารละลายประเภททุติยภูมิ (secondary standard) โดยอาศัยการไทเทรตกับสารละลายมาตรฐานปฐมภูมิ (primary standard) ที่เตรียมความเข้มข้นอย่างแน่นอน
การหาความเข้มข้นแน่นอนโดยการไทเทรต เป็นวิธีที่ง่ายสำหรับการการหาความเข้มข้นแน่นอนของสารละลายทุติยภูมิ เพราะการไทเทรตสามารถรู้ปริมาตรของสารละลาย และสามารถคำนวณความเข้มข้นของสารตามปริมาณสารสัมพันธ์ที่เกิดขึ้นตามปฏิกิริยาเคมี
Link : การคำนวณและวิธีการเตรียมสารละลาย
การคำนวณหาความเข้มข้นแน่นอนของสารละลาย
aA + bB → cC + dD
ต้องการหาความเข้มข้นแน่นอนของสารละลาย A
- A เป็นตัวไทเทรต (เป็นสารละลายทุติยภูมิ)
- B เป็นตัวถูกไทเทรต (เป็นสารละลายปฐมภูมิ)
ในกรณีที่ B ถูกนำมาในสถานะของแข็ง โดยชั่งน้ำหนักที่แน่นอน สามารถคำนวณได้ดังนี้
b x mmol A = a x mmol B
mmol A = (a/b) mmol B
MAVA = (a/b)(mg B/Mw.B)
MA = (a/b)(mg B/Mw.B x VA)
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- โซเดียมไฮดรอกไซด์ (NaOH) (MW. = 40.0 g/mol)
- ฟีนอล์ฟทาลีน (phenolphthalein) 0.1% w/v ชั่งฟีนอล์ฟทาลีน 0.1 กรัม ละลายด้วยเอทานอล 30 mL แล้วเติมน้ำกลั่น 70 mL คนให้ละลายเข้ากัน (เจ้าหน้าที่ห้องปฏิบัติการเตรียมให้แล้ว)
- โพแทสเซียมไฮโดรเจนพทาเลต (KHC8H4O4, KHP) (MW.=204.224 g/mol) ที่ผ่านการอบที่อุณหภูมิ 110°C เป็นเวลา 2 ชั่วโมง และให้เย็นในเดซิเคเตอร์ (สารนี้เป็นสารมาตรฐานปฐมภูมิ)
วิธีการทดลอง (Methodology) :
ตอนที่ 1 เตรียมสารละลาย NaOH
ชั่ง NaOH ประมาณ 1 กรัม (ใช้เครื่องชั่ง 2 ตำแหน่ง) ละลายในบีกเกอร์ เติมน้ำกลั่น 250 mL คนให้ละลาย (บีกเกอร์จะร้อน) อาจจำเป็นต้องแช่ในอ่างน้ำ แล้วรินเก็บใส่ขวดพลาสติกปิดจุก (ห้ามใช้จุกแก้ว) (** ปิดฉลากวันที่เตรียม)
ตอนที่ 2 การหาความเข้มข้นแน่นอน (standardization) ของสารละลาย NaOH
- ชั่งสาร KHC8H4O4 0.50xx g ในบีกเกอร์ 50 mL เติมน้ำปริมาตร 25.00 mL (ใช้ปิเปตขนาด 25.00 mL) แล้วเทใส่ขวดรูปชมพู่ (ทำการทดลองซ้ำอีก 2 ครั้ง)
- เติมฟีนอลฟ์ทาลีน 2-3 หยด แล้วเติมน้ำปริมาตร 00 mL โดยใช้ปิเปต
- ไทเทรตด้วยสารละลาย NaOH ที่บรรจุอยู่ในบิวเรต จนสารละลายเปลี่ยนจากสารละลายใสไม่มีสีเป็นสีชมพูอ่อนอย่างถาวร จดปริมาตร NaOH ที่ใช้ (ตามหลักเลขนัยสำคัญ)
- คำนวณความเข้มข้นของสารละลาย NaOH
ปฏิกิริยา KHP + NaOH → NaKP + H2O
1 mmol NaOH = 1 mmol KHP
MNaOHVNaOH = mgKHP/Mw.KHP
MNaOH = mgKHP/(Mw.KHP x VNaOH)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) : สารเคมีที่เป็นตัวถูกละลายมีทั้งที่เป็นของแข็งและของเหลว การที่จะนำสารเคมีมาเตรียมเป็นสารละลายถูกมีความถูกต้องมากที่สุด พอสรุปเป็นลำดับตามนี้ 1) คำนวณหาน้ำหนักหรือปริมาตรของสารเคมีที่ต้องการ 2) ชั่งหรือตวงสารเคมีให้มีปริมาณตามที่ต้องการ 3) ละลายสารเคมีด้วยตัวทำละลายเล็กน้อย เขย่าผสมให้ละลายให้หมด แล้วจึงปรับปริมาตรด้วยตัวทำละลายให้มีปริมาตรตามขีดบอกปริมาตรของภาชนะ 4) เก็บสารละลายในขวดเก็บสารเคมีพร้อมทั้งปิดฉลากให้เรียบร้อยระบุข้อความให้ชัดเจน สารบางชนิดต้องในที่มืดห้ามโดนแสง บางชนิดต้องแช่เย็น บางชนิดต้องเก็บในขวดพลาสติก ผู้เตรียมต้องศึกษาเพิ่มเติม
 สารละลายบางประเภทอาจมีวิธีการเตรียมที่แตกต่างกัน เช่นอาจละลายในตัวทำละลายผสมของสารอินทรีย์กับน้ำ การเตรียมต้องละลายสารด้วยตัวทำละลายอินทรีย์ก่อนแล้วจึงปรับปริมาตรด้วยน้ำ หรืออาจต้องละลายด้วยกรดเล็กน้อย ดังนั้นผู้เตรียมจำเป็นต้องศึกษาวิธีการเตรียมสารละลายให้ถูกต้อง
Link : การคำนวณและวิธีการเตรียมสารละลาย
สารละลายบางประเภทอาจมีวิธีการเตรียมที่แตกต่างกัน เช่นอาจละลายในตัวทำละลายผสมของสารอินทรีย์กับน้ำ การเตรียมต้องละลายสารด้วยตัวทำละลายอินทรีย์ก่อนแล้วจึงปรับปริมาตรด้วยน้ำ หรืออาจต้องละลายด้วยกรดเล็กน้อย ดังนั้นผู้เตรียมจำเป็นต้องศึกษาวิธีการเตรียมสารละลายให้ถูกต้อง
Link : การคำนวณและวิธีการเตรียมสารละลาย
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- HCl 36%w/w (Mw.=36.46 g/mol, d=1.18 g/mL)
- เมทิลออเรนจ์ (methyl orange) (เจ้าหน้าที่ห้องปฏิบัติการเตรียมให้แล้ว)
- Na2CO3 (Mw.=99 g/mol) อบที่อุณหภูมิ 120°C เป็นเวลา 2 ชั่วโมงและให้เย็นในเดซิเคเตอร์
- ชั่ง Na2CO3 0.10xx กรัม ในบีกเกอร์ 50 mL เติมน้ำ 25.00 mL (ใช้ปิเปตขนาด 25 mL) แล้วเทใส่ขวดรูปชมพู่ (ทำการทดลอง 3 ครั้ง)
- เติมสารละลายอินดิเคเตอร์เมทิลออเรนจ์ 5-6 หยด
- ไทเทรตด้วยสารละลาย HCl ที่บรรจุอยู่ในบิวเรต จนสารละลายเปลี่ยนจากสารละลายเหลืองส้มเป็นสีแดง จดปริมาตรสารละลาย HCl ที่ใช้ (ตามหลักเลขนัยสำคัญ)
- คำนวณความเข้มข้นของสารละลาย HCl
mmol HCl = 2 mmol Na2CO3
MHClVHCl = 2 x (mg Na2CO3/Mw.Na2CO3)
MHCl = 2 x (mg Na2CO3/(105.99 g/mol x VHCl)
การทดลอง 3.1 : การหาปริมาณกรดแร่ในน้ำส้มสายชูกลั่น (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
xxx
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- น้ำส้มสายชู
- สารละลาย NaOH (จากการทดลองที่ 2.1)
- ฟีนอล์ฟทาลีน
วิธีการทดลอง (Methodology) :
1. การเตรียมสารละลายตัวอย่างน้ำส้มสายชู
ปิเปตน้ำส้มสายชู 5.00 mL (ใช้ปิเปต) ใส่ลงในขวดกำหนดปริมาตร 100 mL แล้วเจือจางด้วยน้ำกลั่นจนถึงขีดบอกปริมาตร จะมีอัตราส่วนเจือจาง (dilution factor) 20 เท่า
2. การทดลอง
ตอนที่ 1 การหาความเข้มข้นแน่นอนของสารละลาย NaOH (ทำการทดลองเช่นเดียวกับการทดลองที่ 2.1)
- คำนวณความเข้มข้นแน่นอนของสารละลาย NaOH ในหน่วย mol/L
ตอนที่ 2 การไทเทรตหาปริมาณกรดแอซีติก (%w/v) ในน้ำส้มสายชูกลั่น
- ปิเปตน้ำส้มสายชูที่เตรียมไว้ ปริมาตร 25.00 mL ใส่ลงในขวดรูปชมพู่ขนาด 250 mL
- เติมสารละลายอินดิเคเตอร์ฟีนอล์ฟทาลีน 2-3 หยด
- ไทเทรตกับสารละลาย NaOH ที่บรรจุในบิวเรต จนกระทั่งสารละลายเปลี่ยนจากสารละลายใสไม่มีสีเป็นสีชมพูอ่อนอย่างถาวร จดปริมาตรของสารละลาย NaOH ที่ใช้ (ตามหลักเลขนัยสำคัญ)
- คำนวณความเข้มข้น CH3COOH ในสารตัวอย่าง
- คำนวณ %(w/v) CH3COOH ในสารตัวอย่าง
การคำนวณ :
ปฏิกิริยา CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
1 mmol CH3COOH = 1 mmol NaOH
การทดลอง 3.2 : การหาปริมาณอัลคานิตีรวมในโซดาแอซ (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
xxx
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- สารตัวอย่าง (รับจากอาจารย์คุมการทดลอง)
- สารละลาย HCl (จากการทดลองที่ 2.2)
- สารละลายอินดิเคเตอร์เมทิลออเรนจ์
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความเข้มข้นแน่นอนของสารละลาย HCl (ทำเช่นเดียวกับการทดลองที่ 2.2)
- คำนวณความเข้มข้นแน่นอนของสารละลาย HCl ในหน่วย mol/L
ตอนที่ 2 การวิเคราะห์หาปริมาณโซเดียมคาร์บอเนตในโซดาแอช
- ชั่งสารตัวอย่างให้มีปริมาณระหว่าง 0.10-0.15 กรัม แล้วใส่ลงในขวดรูปชมพู่ ละลายด้วยน้ำกลั่น 50.00 mL (ทำ 3 ขวด)
- เติมสารละลายอินดิเคเตอร์เมทิลออเรนจ์ 5-6 หยด
- ไทเทรตด้วยสารละลาย HCl ที่บรรจุอยู่ในบิวเรต จนสารละลายเปลี่ยนจากสารละลายเหลืองส้มเป็นสีแดง จดปริมาตรสารละลาย HCl ที่ใช้ (ตามหลักเลขนัยสำคัญ)
- คำนวณร้อยละโดยน้ำหนัก Na2CO3 ในสารตัวอย่าง
การคำนวณ :
ปฏิกิริยา Na2CO3 + 2HCl → CO2 + 2NaCl + H2O
1 mmol Na2CO3 = 2 mmol HCl
การทดลอง 4.1 : การหาปริมาณคลอไรด์โดยวิธีของโมร์ (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
วิธีการวิเคราะห์คลอไรด์โดยวิธีของโมร์เป็นวิธีการไทเทรตโดยตรง ใช้ได้ดีในช่วงความเข้มข้น 0.15-10 มิลลิกรัมคลอไรด์ วิธีนี้ใช้ซิลเวอร์ไนเทรต (AgNO3) เป็นตัวไทเทรต (titrant) ทำปฏิกิริยากับคลอไรด์ไอออน (Cl–) โดยมีโพแทสเซียมโครเมต (K2CrO4) เป็นอินดิเคเตอร์ เมื่อ Ag+ ทำปฏิกิริยาพอดีกับคลอไรด์ไอออนในตัวอย่างทั้งหมดแล้ว Ag+ จะทำปฏิกิริยากับ CrO4–
สารละลาย AgNO3 ต้องทำการหาความเข้มข้นแน่นอนด้วยสารละลายมาตรฐานปฐมภูมิ NaCl ในการไทเทรตคลอไรด์ไอออนจะตกเป็นตะกอนสีขาวของซิลเวอร์คลอไรด์ (AgCl) ดังสมการ
Ag+ (aq) + Cl– (aq) → AgCl(s)
เกลือ AgCl ละลายน้ำได้น้อยมาก
Ksp = [Ag+][Cl–] = 1.6 x10-10)
จุดยุติ (end point) ของปฏิกิริยาไม่สามารถวัดด้วยตาเปล่า จึงต้องใช้อินดิเคเตอร์โครเมตไอออน (CrO42-) ทำหน้าที่เป็นอินดิเคเตอร์โดยให้สีแดงเข้มของซิลเวอร์โครเมต (Ag2CrO4) เนื่องจากอินดิเคเตอร์ชนิดนี้ต้องการปริมาณน้ำยาเคมีที่ใช้ในการไทเทรตที่มากเกินพอเพื่อที่จะให้เกิดตะกอนที่มีสีซึ่งตาสามารถมองเห็นได้ ในขณะที่ถึงจุดยุตินั้นคลอไรด์ในน้ำจะหมดไปเมื่อหยดสารละลาย AgNO3 ลงมาอีก Ag+ จะทำปฏิกิริยากับ CrO4– ทำให้เกิดตะกอนสีแดงเข้มของ Ag2CrO4 ดังสมการ
2Ag+(aq) + CrO42-(aq) → Ag2CrO4(s)
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- AgNO3 (Mw.=169.87 g/mol) ชั่ง AgNO3 ประมาณ 1.2x กรัม ในบีกเกอร์ 50 mL ละลายด้วยน้ำกลั่นเล็กน้อย เทใส่ขวดกำหนดปริมาตร 500 mL ปรับปริมาตรด้วยน้ำกลั่น เก็บไว้ในขวดสีชา
- NaCl (Mw.=58.44 g/mol) ชั่ง NaCl 0.206x กรัม (ที่ผ่านการอบที่ 120°C เวลาประมาณ 2 ชม.) ในบีกเกอร์ 50 mL ละลายด้วยน้ำกลั่นเล็กน้อย เทใส่ขวดกำหนดปริมาตร 250 mL ปรับปริมาตรด้วยน้ำกลั่น คำนวณความเข้มข้นในหน่วย นอร์มัล (N)
- โพแทสเซียมโครเมต (K2CrO4) ละลาย K2CrO4 4.00 กรัมในน้ำกลั่นปริมาตร 100 mL เติมสารละลาย AgNO3 ทีละหยดจนเกิดตะกอนสีแดงของซิลเวอร์โครเมตขึ้น ตั้งทิ้งไว้ 12 ชั่วโมง กรองตะกอนทิ้งไป (เจ้าหน้าที่ห้องปฏิบัติการเตรียมให้)
- น้ำตัวอย่าง แต่ละกลุ่มเตรียมน้ำดื่ม หรือน้ำที่ต้องการวิเคราะห์
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความเข้มข้นแน่นอนของสารละลาย AgNO3
- ปิเปตสารละลาย NaCl 10.00 mL ลงในขวดรูปชมพู่ขนาด 250 mL เติมน้ำกลั่น 10.00 mL
- เติมสารละลาย K2CrO4 0.5 mL (ประมาณ 10 หยด)
- ไทเทรตด้วยสารละลาย AgNO3 ที่บรรจุในบิวเรตและเขย่าขวดรูปชมพู่อยู่เสมอ สังเกตสีแดงของสารละลายเมื่อเติมสารละลาย AgNO3 ลงไป จนกระทั่งได้ตะกอนสีเหลืองอมส้ม (สีอิฐ) ถือว่าเป็นจุดยุติ (ระมัดระวังในการสังเกตสีของตะกอน)
- จดปริมาตรสารละลาย AgNO3 ที่ใช้ไป (ตามหลักเลขนัยสำคัญ)
- คำนวณความเข้มข้นแน่นอนของสารละลาย AgNO3 หน่วยนอร์มัล
ตอนที่ 2 การไทเทรตหาปริมาณคลอไรด์ในน้ำตัวอย่าง
- เตรียมตัวอย่างน้ำ 10.00 mL ลงในขวดรูปชมพู่ขนาด 250 mL เติมน้ำกลั่น 10.00 mL (ทำการทดลองซ้ำ 3 ซ้ำ)
- ปรับ pH ของน้ำตัวอย่างอยู่ในช่วง 7-8 โดยใช้สารละลาย NaOH 1 mol/L หรือ H2SO4 0.1 mol/L
- เติมสารละลาย K2CrO40 mL (20 หยด)
- ไทเทรตด้วยสารละลาย AgNO3 จนกระทั่งได้ตะกอนสีเหลืองอมส้ม (สีอิฐ) ถือว่าเป็นจุดยุติ
ตอนที่ 3 การทำแบลงค์ (Blank)
ทำการทดลองเหมือนตอนที่ 2 แต่ใช้น้ำกลั่น 100 mL แทนน้ำตัวอย่าง (ค่า Blank ควรอยู่ระหว่าง 0.2-0.4 mL)
การคำนวณ :
A = ปริมาตร (mL) ของสารละลาย AgNO3 ที่ใช้ในการไทเทรตตัวอย่างน้ำ
B = ปริมาตร (mL) ของสารละลาย AgNO3 ที่ใช้ในการไทเทรตแบลงค์
N = นอร์มัลของสารละลาย AgNO3
หมายเหตุ สารละลายในการทดลองนี้มีโครเมียม (Cr) ซึ่งมีความเป็นพิษสูง ให้นักศึกษาทิ้งสารละลายในถังบรรจุของเสียที่เป็น Cr3+/Cr6+ ห้ามทิ้งลงอ่างน้ำ
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) : การหาค่าออกซิเจนละลาย (dissolved oxygen, DO) คือการหาปริมาณของออกซิเจนที่ละลายในน้ำ ปริมาณออกซิเจนในน้ำเป็นลักษณะที่สำคัญที่จะบอกให้ทราบว่าน้ำนั้นมีความเหมาะสมเพียงใดในการดำรงชีวิตของสิ่งมีชีวิตในน้ำ ค่าการละลายของออกซิเจนในน้ำจะอยู่ในช่วง 14.6 mg/L ที่ 0°C และ 7 mg/L ที่ 35°C ภายใต้ความดัน 1 บรรยากาศ ในน้ำเสียค่าอิ่มตัวของออกซิเจนที่ละลายน้อยกว่าในน้ำสะอาด การวิเคราะห์หาค่าออกซิเจนละลายทำได้หลายวิธี เช่นการใช้เครื่องวัดเรียกว่า ดีโอมิเตอร์ (DO meter) ซึ่งเป็นเครื่องมือที่สามารถวัดปริมาณออกซิเจนละลายในน้ำได้โดยตรง (หน่วยเป็นมิลลิกรัมต่อลิตร) หรือจะใช้วิธีทางเคมี เช่น วิธีเอไซด์โมดิฟิเคชันของไอโอเมตริก (azide modification of iodometric method) ในการทดลองนี้จะใช้วิธีเอไซด์โมดิฟิเคชันของไอโอเมตริก ซึ่งเป็นการไทเทรตแบบเกิดปฏิกิริยารีดอกซ์ (redox reaction) อาศัยปฏิกิริยาเคมีจากการเติมแมงกานีสซัลเฟต และอัลคาไลด์ไอโอไดด์เอไซด์ ไปเกิดปฏิกิริยากับแก๊สออกซิเจนที่ละลายในน้ำ แล้วรวมตัวเป็นตะกอนสีน้ำตาลของแมงกานีสไฮดรอกไซด์ (Mn(OH)2) ดังสมการ
MnSO4(aq) + NaOH(aq) + O2(g) → Mn(OH)2(s)
ตะกอน Mn(OH)2 จะละลาย เมื่อเติมกรดซัลฟิวริกและเกิดสารละลายสีเหลืองของไอโอดีน (I2) ดังสมการMn(OH)2(s) + 4H+(aq) + 2I–(aq) → Mn2+(s) + I2(aq) + 3H2O(l)
ปริมาณไอโอดีนที่เกิดขึ้นจะสัมพันธ์กับปริมาณออกซิเจนละลายในน้ำตามปริมาณสัมพันธ์ สามารถหาปริมาณไอโอดีนที่เกิดขึ้นโดยไทเทรตกับสารละลายโซเดียมไธโอซัลเฟต (Na2S2O3) ดังสมการI2(aq) + 2S2O32-(aq) → 2I–(aq) + S4O62-(aq)
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
- ขวด DO ขนาด 300 mL
สารเคมี (Reagents) :
- สารละลายแมงกานีสซัลเฟต (manganese sulfate) ละลาย MnSO4×4H2O 48.0 กรัม หรือ ในน้ำกลั่นแล้วทำให้เจือจางเป็น 100 mL (อาจารย์ผู้ควบคุมเตรียมให้)
- อัลคาไลน์ ไอโอไดด์ เอไซด์ (alkaline-iodide-azide) ละลาย NaOH 50 กรัม และ NaI 13.5 กรัมในน้ำกลั่นแล้วทำให้เจือจางปริมาตร 100 mL และเติมโซเดียมเอไซด์ (NaN3) 1 กรัม (ซึ่งละลายในน้ำกลั่น 4 mL) (อาจารย์ผู้ควบคุมเตรียมให้)
- น้ำแป้ง ละลายแป้ง 1.6 กรัม เติมกรดซาลิไซลิก 0.2 กรัม ในน้ำร้อนเดือด 100 mL
- Na2S2O3×5H2O 0.025 N ชั่ง Na2S2O3×5H2O (Mw=248.18 g/mol) 6.02xx กรัม ในบีกเกอร์ 50 mL ละลายน้ำกลั่นเล็กน้อย และเติม NaOH 0.4 กรัม เติมน้ำกลั่นให้ปริมาตรเป็น 1000 mL
- KH(IO3)2 0.025 N ชั่ง KH(IO3)2 (Mw=389.92 g/mol) 0.4062 กรัม (ผ่านการอบที่ 105°C) ในบีกเกอร์ 50 mL ละลายน้ำกลั่นเล็กน้อย เทใส่ขวดวัดปริมาตร 500 mL ปรับปริมาตรครบขีดปริมาตร
- ชั่ง KI 2 กรัม ในบีกเกอร์ 50 mL แล้วเทใส่ในขวดรูปชมพู่ 250 mL เติมน้ำกลั่น 100 mL
- เติมสารละลาย H2SO4 0.50 mL ด้วยปิเปต 1.00 mL
- เติมสารละลาย KH(IO3)2 00 mL (ใช้ปิเปต 20.00 mL) ใส่ลงไป เขย่าให้เข้ากัน
- ไทเทรตกับสารละลาย Na2S2O3 ที่บรรจุในบิวเรต จนสารละลายเป็นสีเหลืองอ่อน ให้หยุดไทเทรตไว้ก่อน ให้เติมน้ำแป้ง 20 หยด แล้วไทเทรตต่อจนสารละลายเปลี่ยนจากสีน้ำเงินเป็นสารละลายใสไม่มีสี
- จดปริมาตรของสารละลาย Na2S2O3 (ตามหลักเลขนัยสำคัญ)
- คำนวณความเข้มข้นของสารละลาย Na2S2O3 หน่วยนอร์มัล (N)
- เก็บน้ำตัวอย่างในขวด DO (แนะนำวิธี ขั้นตอนและข้อควรระวังในการเก็บตัวอย่าง)
- เติมสารละลาย MnSO4 1 mL และสารละลายอัลคาไลน์ ไอโอไดด์ เอไซด์ 1 mL ลงในขวด BOD โดยให้ปลายปิเปตแตะที่ปากขวดเหนือผิวน้ำตัวอย่างเล็กน้อย (อย่าให้ปลายปิเปตจุ่มลงในน้ำตัวอย่าง) ปิดจุกขวด ระวังอย่าให้มีฟองอากาศ ผสมให้เข้ากันโดยคว่ำขวดขึ้นลง 15 ครั้ง เพื่อให้ของเหลวผสมเข้ากัน ปฏิกิริยาที่เกิดขึ้น
- ตะกอนสีขาวของ Mn(OH)2 จะถูกออกซิไดซ์โดยออกซิเจนในน้ำเป็นตะกอนสีน้ำตาลของแมงกานีส (IV) ออกซีไฮดรอกไซด์ (MnO(OH)2)
- ตั้งทิ้งไว้ให้ตกตะกอนจนได้ปริมาณน้ำใส ½ ของขวด (ปริมาณตะกอนขึ้นอยู่กับปริมาณออกซิเจนที่ละลายในน้ำ)
- เติม H2SO4 1 mL โดยให้กรดค่อย ๆ ไหลไปข้างขวด ปิดจุกผสมให้เข้ากันโดยคว่ำขวดขึ้นลงจนกระทั่งตะกอนละลายหมด ในขั้นตอนนี้แมงกานีส (IV) จะออกซิไดซ์ไอโอไดด์ (I–) เป็นไอโอดีน (I2) ทันที ซึ่งให้สารละลายสีเหลืองใส
- ตวงสารละลายปริมาตร 201 mL ใส่ในขวดรูปชมพู่ 250 mL (โดยใช้กระบอกตวง 100 mL และปิเปต 1 mL)
- ไทเทรตกับสารละลาย Na2S2O3 ที่บรรจุในบิวเรต จนสารละลายเป็นสีเหลืองอ่อนให้หยุดไทเทรต แล้วเติมน้ำแป้ง 1 mL (20 หยด) แล้วไทเทรตต่อจนสารละลายเปลี่ยนจากสีน้ำเงินเป็นสารละลายไม่มีสี
- จดปริมาตรของสารละลาย Na2S2O3 (ตามหลักเลขนัยสำคัญ)
- คำนวณปริมาณออกซิเจนละลายในน้ำ (หน่วย mg/L)
การทดลอง 4.3 : การหาความกระด้างรวมในตัวอย่างน้ำ (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
ความกระด้างของน้ำเป็นการวัดความสามารถของน้ำที่จะตกตะกอนสบู่ สบู่จะถูกทำให้ตกตะกอนโดย Ca2+ และ Mg2+ ในน้ำเป็นส่วนใหญ่ แต่อาจตกตะกอนโดยไอออนตัวอื่น ๆ เช่น Al3+, Fe2+, Mn2+, Sr2+, Zn2+ ได้ด้วย แต่เนื่องจากไอออน Ca2+ และ Mg2+ มีอยู่ในน้ำธรรมชาติเป็นปริมาณมาก ดังนั้นจึงให้คำจำกัดความของความกระด้างของน้ำว่าเป็นสมบัติของน้ำ ซึ่งแทนค่าความเข้มข้นทั้งหมดของ Ca2+ และ Mg2+ ซึ่งบอกในรูปมิลลิกรัมต่อลิตร (mg/L หรือ ppm) ของแคลเซียมคาร์บอเนต (CaCO3) เช่น น้ำอ่อน, น้ำค่อนข้างกระด้าง, น้ำกระด้าง และน้ำกระด้างมากจะมีความกระด้างเป็น 0-75, 75-150, 150-300 และมากกว่า 300 mg/L as CaCO3 ตามลำดับ
ความกระด้างของน้ำจะแสดงในหน่วยมิลลิกรัมต่อลิตรของเกลือแคลเซียมคาร์บอเนต ในการวิเคราะห์จะนำน้ำตัวอย่างมาทำการไทเทรตด้วยสารละลาย EDTA โดยมี eriochrome Black-T เป็นอินดิเคเตอร์
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
สารเคมี (Reagents) :
- CaCO3 (MW=100.01 g/mol) ชั่ง CaCO30000 กรัม (ที่ผ่านการอบที่อุณหภูมิ 105°C นาน 1 ชั่วโมง) ในบีกเกอร์ 50 mL ละลายด้วยน้ำกลั่นประมาณ 25.00 mL จนละลายหมด ต้มจนดือดเพื่อไล่ CO2 จึงเทสารทั้งหมดลงในขวดกำหนดปริมาตรขนาด 1000 mL แล้วปรับปริมาตรด้วยน้ำกลั่น (1 mL = 1 mg CaCO3)
- EDTA (MW=372.24 g/mol) ชั่ง Na2EDTA×2H2O หนักประมาณ 3.725 กรัม (ที่ผ่านการอบที่อุณหภูมิ 80°C นาน 1 ชั่วโมง) ละลายในน้ำ 700 mL กวนสารละลายโดยใช้แท่งแม่เหล็ก เติม NaOH ทีละน้อย ๆ (ประมาณ 5 กรัม) คนจนละลายหมดแล้วปรับปริมาตรด้วยน้ำกลั่นให้ได้ 1000 mL
- สารละลาย eriochrome black-T 1% w/v ละลาย eriochrome black-T 1.0 กรัม ใน 100 mL (20:20:60 v/v ethanol : ethanolamine : H2O)
- บัฟเฟอร์ pH 10 (NH4Cl-NH3) ชั่งเกลือ NH4Cl 6.8 กรัม ละลายด้วยสารละลายแอมโมเนียเข้มข้น 57 mL แล้วเจือจางด้วยน้ำกลั่นจนครบปริมาตร 100 mL
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความเข้มข้นแน่นอนของสารละลาย EDTA
- ปิเปตสารละลาย CaCO3 ปริมาตร 10.00 mL ลงในขวดรูปชมพู่ขนาด 250 mL และเติมสารละลายบัฟเฟอร์ 2 mL
- เติมสารละลาย eriochrome black-T 4-5 หยด
- ไทเทรตกับสารละลาย EDTA จนสารละลายเปลี่ยนจากม่วงแดงเป็นสีฟ้าอย่างถาวร
- บันทึกปริมาตรสารละลาย EDTA
- คำนวณความเข้มข้นแน่นอนของสารละลาย EDTA
>> Click การคำนวณการหาความเข้มข้นแน่นอนของสารละลาย EDTA
ตอนที่ 2 การวิเคราะห์หาความกระด้างของน้ำ
- ตวงน้ำตัวอย่าง 50 mL ใสในขวดรูปชมพู่ 250 mL และเติมสารละลายบัฟเฟอร์ 2 mL
- เติมสารละลาย eriochrome black-T 4-5 หยด (สารละลายเป็นสีม่วงแดง ถ้าน้ำตัวอย่างมีความกระด้าง)
- ไทเทรตกับสารละลาย EDTA จนสารละลายกลายเป็นสีฟ้าอย่างถาวร
- คำนวณความกระด้างรวม (ในหน่วย mg/L as CaCO3)
>> Click การคำนวณหาความกระด้างรวมในน้ำ
การคำนวณ :
สมการ
การทดลอง 5.1 : การวิเคราะห์โดยวิธีโพเทนชิโอเมตริกไทเทรชัน (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
xxx
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- บิวเรต
- เครื่องวัดพีเอช (pH meter)
- เครื่องกวนสารละลายแบบแม่เหล็ก
สารเคมี (Reagents) :
- โพแทสเซียมไฮโดรเจนพธาเลต (KHC8H4O4)
- โซเดียมไฮดรอกไซด์ (NaOH)010 mol/L
- สารละลาย HCl 0.010 mol/L และ CH3COOH 0.010 mol/L
- สารละลายบัฟเฟอร์
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความเข้มข้นแน่นอนของสารละลาย NaOH
ทำการทดลองเหมือนการทดลองที่ 2.1 [Click]
ตอนที่ 2 การทำกราฟไทเทรชันของสารละลาย HCl
- (*เจ้าหน้าที่) เตรียมเครื่องวัด pH ตามคำแนะนำของเจ้าหน้าที่ผู้ควบคุม ฉีดล้างขั้วไฟฟ้าด้วยน้ำกลั่น ซับเบาๆ ด้วยกระดาษทิชชูแล้วทำการปรับค่ามาตรฐาน (calibration) โดยจุ่มขั้วไฟฟ้าลงในขวดสารละลายบัฟเฟอร์มาตรฐานพีเอช 4, 7 และ 10 ตามลำดับ (ควรทำตามคำแนะนำของเจ้าหน้าที่และอาจารย์ผู้ควบคุมอย่างเคร่งครัด โดยเฉพาะการใช้งานขั้วอิเล็กโทรด)
- ปิเปตสารละลาย HCl 20.00 mL ถ่ายใส่ลงในบีกเกอร์ขนาด 250 mL เติมน้ำกลั่นประมาณ 75.00 mL (ให้ท่วมกระเปาะขั้วไฟฟ้า) ใส่แท่งแม่เหล็กที่ล้างสะอาดแล้วปรับให้หมุนอย่างสม่ำเสมอด้วยเครื่องกวนแท่งแม่เหล็ก
- จุ่มขั้วไฟฟ้าที่ล้างสะอาดลงไป โดยให้สารละลายอยู่ในระดับท่วมกระเปาะแก้ว ระวังอย่าให้กระทบแท่งแม่เหล็ก และผนังบีกเกอร์
- บรรจุสารละลาย NaOH ลงในบิวเรต จัดให้ปลายบิวเรตอยู่ในระดับ และตำแหน่งที่พอเหมาะ
- เตรียมกระดาษกราฟ เขียนแกน x และ y ให้มีอัตราส่วน (scale) ที่เหมาะสม
- อ่านค่า pH เริ่มต้นของสารละลาย แล้วเริ่มไทเทรตโดยปล่อยสารละลาย NaOH ลงมาครั้งละ 1.0 mL บันทึกค่า pH ที่ได้ พร้อมทั้งลากกราฟเพื่อหาจุดยุติ (ตามรูปที่ 5.2) ปริมาตรสารละลาย NaOH หลังจุดยุติควรมีปริมาตรเท่ากับก่อนจุดยุติ
- ทำการทดลองเหมือนเดิมอีกครั้ง แต่ช่วงก่อนถึงจุดยุติและหลังจุดยุติประมาณ 2 mL ให้ปล่อยสารละลาย NaOH ทีละ 0.10 mL บันทึกค่า pH สำหรับเขียนกราฟอนุพันธ์ (ตามรูปที่ 5.3)
ตอนที่ 3 การทำกราฟไทเทรชันของ CH3COOH
ทำการทดลองเช่นเดียวกับตอนที่ 2 แต่เปลี่ยนจากสารละลาย HCl เป็นสารละลาย CH3COOH 0.0100 mol/L
การทดลอง 6.1 : การหาปริมาณเหล็กรวมในน้ำด้วยวิธียูวี-วิสิเบิลสเปกโทรโฟโตเมตรี (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
การหาปริมาณน้อยของเหล็กสามารถทำได้โดยการทำให้เหล็กเกิดสารเชิงซ้อนที่มีสี (สีแดงถึงส้ม) ระหว่างไอออน Fe2+ กับ 1,10-phenanthroline ที่เรียกว่าสารเชิงซ้อนเหล็กฟีแนนโทรลีน สารเชิงซ้อนไม่ขึ้นกับ pH ช่วงระหว่าง 3-9 โดยทั่วไปจะให้ pH ประมาณ 3.5 เพื่อป้องกันการตกตะกอนของเกลือเหล็ก เช่น เกลือฟอตเฟส เป็นต้น ในการทำให้เกิดสารเชิงซ้อนกับฟีแนนโทรลีน จะต้องทำการรีดิวซ์เหล็กทั้งหมดในสารละลายให้เป็นเหล็ก(II) เสียก่อนหรือไฮดรอกซีลามีนไฮโดรคลอไรด์ (hydroxylamine hydrochloride) สีของสารเชิงซ้อนระหว่างเหล็ก (II) กับฟีแนนโทรลีนจะเสถียรได้นาน
4Fe3++ 2NH2OH → 4Fe2++ N2O + 4H+ + H2O
Fe2+(aq) + 3PhH+ → Fe(Ph)32+ + 3H+

อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- เครื่อง UV-vis
สารเคมี (Reagents) :
- สารละลายมาตรฐานเหล็ก 10 ppm (เตรียมจาก stock 1000 ppmFe) ในขวดกำหนดปริมาตร 25 mL
- สารละลาย NH2OH×HCl 10%(w/v)
- สารละลายอะซิเตดบัฟเฟอร์ ละลาย CH3COONH4 250 กรัม ในน้ำกลั่น 100 mL เติมสารละลาย CH3COOH 700 mL เติมน้ำกลั่นจนครบปริมาตร 1000 mL
- สารละลายฟีแนนโทรลีน (1,10-phenanthrolien, 1% w/v)
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความยาวคลื่นสูงสุด (λmax)
- ปิเปต 1.00 mL ของสารละลายมาตรฐานเหล็ก 10 ppm Fe ใส่ลงในขวดกำหนดปริมาตรขนาด 25.00 mL
- เติมสารละลาย NH2OH×HCl 1 mL และสารละลายบัฟเฟอร์ 1 mL
- เติมสารละลาย 1,10-phenanthrolien 2 mL แล้วเติมน้ำกลั่นลงใปจนครบขีดปริมาตร เขย่าให้เข้ากันแล้วตั้งทิ้งไว้ประมาณ 10 นาทีจะได้สีของสารละลายเชิงซ้อนสีแดงของเหล็กฟีแนนโทรลีน
- นำสารละลายไปวัดการดูดกลืนแสงที่ความยาวคลื่นตั้งแต่ 800-400 nm
- นำผลที่วัดได้ไปเขียนความสัมพันธ์ระหว่างค่าการดูดกลืนแสงและความยาวคลื่น
ตอนที่ 2 การทำกราฟมาตรฐาน (standard calibration curve)
- เตรียมขวดกำหนดปริมาตรขนาด 25.00 mL จำนวน 6 ขวด แล้วปิเปตสารละลายมาตรฐานเหล็ก 10 ppm Fe ปริมาตร 0, 0.50, 1.00, 2.00, 3.00, 4.00 และ 5.00 mL ตามลำดับ (โดยใช้ปิเปตอันเดียวกัน) (**ขวดที่ 1 เป็นแบลงค์)
- ทำการทดลองเช่นเดียวกับตอนที่ 1
- นำผลที่วัดได้ไปเขียนกราฟมาตรฐานความเข้มข้น โดยเขียนระหว่างความเข้มข้นของสารละลายมาตรฐานเหล็กกับค่าการดูดกลืนแสงที่วัดได้
ตอนที่ 3 การวิเคราะห์หาปริมาณเหล็กรวมทั้งหมดในน้ำตัวอย่าง
- ปิเปตน้ำตัวอย่างที่ได้รับใส่ลงในขวดกำหนดปริมาตรขนาด 25.00 mL 3 ขวดๆ ละ 10.00 mL (ถ้าในน้ำตัวอย่างมีตะกอนหรือสิ่งเจือปนให้กรองเสียก่อน)
- ทำการทดลองเช่นเดียวกับตอนที่ 1 แต่วัดการดูดกลืนแสงที่ความยาวคลื่น 510 nm
- คำนวณหาปริมาณของเหล็กโดยเทียบกับกราฟมาตรฐาน แล้วคำนวณปริมาณเหล็กในน้ำตัวอย่าง
การทดลอง 6.2 : การหาปริมาณแอสไพรินด้วยวิธียูวี-วิสิเบิลสเปกโทรโฟโตเมตรี (เวลา 2 ชั่วโมง)
| จุดประสงค์ |
|
| Infographic การทดลอง | Download บทปฏิบัติการ | แบบรายงานการทดลอง |
หลักการ (Principle) :
…อยู่ระหว่างเพิ่มเติม…
อุปกรณ์ (Equipments) :
- เครื่องชั่งไฟฟ้า ความละเอียด 4 ตำแหน่ง
- เครื่อง UV-vis
สารเคมี (Reagents) :
- กรดซาลิไซลิกความเข้มข้น 100 ppm โดยชั่งกรดซาลิไซลิก 0.100 กรัม ละลายด้วยสารละลาย NaOH 5 mol/L ปริมาตร 10.00 mL เทใส่ขวดกำหนดปริมาตร ขนาด 100 mL ปรับปริมาตรด้วยน้ำกลั่น
- สารละลาย Fe3+ (100 mol/L) โดยชั่ง FeCl3 (anhydrous) 1.62 กรัม ละลายลงในขวดกำหนดปริมาตรขนาด 100 mL และปรับปริมาตรด้วยน้ำกลั่น
- เตรียมสารตัวอย่าง ทำการบดยาเม็ดให้ละเอียด ชั่งน้ำหนัก 1.00 g แล้วละลายด้วยสารละลาย NaOH 0.5 mol/L ปริมาตร 1.00 mL ตั้งทิ้งไว้ประมาณ 10 นาที เทลงในขวดกำหนดปริมาตรขนาด 25.00 mL ปรับปริมาตรด้วยน้ำกลั่น
วิธีการทดลอง (Methodology) :
ตอนที่ 1 การหาความยาวคลื่นสูงสุด (λmax)
- เตรียมขวดวัดปริมาตร 25.00 mL 1 ขวด เติมสารละลายกรดซาลิไซลิก 1.0 mL และเติมสารละลาย Fe3+ 4.0 mL แล้วปรับปริมาตรด้วยน้ำกลั่น
- นำสารละลายไปวัดการดูดกลืนแสงที่ความยาวคลื่นตั้งแต่ 800-400 nm
- นำผลที่วัดได้ไปเขียนกราฟการดูดกลืน ระหว่างค่าการดูดกลืนแสงกับความยาวคลื่น
ตอนที่ 2 การเตรียมกราฟมาตรฐานความเข้มข้น
- เตรียมขวดกำหนดปริมาตรขนาด 25.00 mL จำนวน 6 ขวด แล้วปิเปตสารละลายกรดซาลิไซลิก ปริมาตร 0, 1.0, 1.5, 2.5, 4.0 และ 5.0 mL ตามลำดับ (**ขวดที่ 1 เป็นแบลงค์) และเติมสารละลาย Fe3+ 4.0 mL แล้วปรับปริมาตรด้วยน้ำกลั่น
- วัดการดูดกลืนแสงที่ความยาวคลื่นสูงสุด (λmax)
- บันทึกค่าการดูดกลืนแสงของความเข้มข้นของกรดซาลิไซลิกที่แตกต่างกัน
- เขียนกราฟมาตรฐานความเข้มข้น คำนวณหาความชัน และจุดตัดแกน โดยใช้โปรแกรม MS Excel
ตอนที่ 3 การทดลองหาปริมาณแอสไพรินในยาเม็ด
- ตวงสารละลายตัวอย่างลงในขวดวัดปริมาตรขนาด 25.00 mL 3 ขวดๆ ละ 10.00 mL
- เติมสารละลาย Fe3+4.0 mL แล้วปรับปริมาตรด้วยน้ำกลั่น
- วัดการดูดกลืนแสงที่ความยาวคลื่นสูงสุด (λmax)
- คำนวณหาปริมาณโดยเทียบกับกราฟมาตรฐาน