ผู้ช่วยศาสตราจารย์ ดร.วรวิทย์ จันทร์สุวรรณ
ปรับปรุงล่าสุด: 31 พฤษภาคม 2565

กราฟมาตรฐานสำหรับการวิเคราะห์ด้วยเครื่องมือ
วีธีกราฟมาตรฐานเป็นหลักการที่สำคัญสำหรับการวิเคราะห์เชิงปริมาณโดยการใช้เครื่องมือวิเคราะห์ (instrumental analysis) เกือบทุกเทคนิค เมื่อทำการวิเคราะห์เครื่องมือจะรายงานสัญญาณตอบสนอง (responsible signal) ที่วัดได้ในรูปแบบใดรูปแบบหนึ่ง เราอาจจำแนกสัญญาณตอบสนองในเครื่องมือวิเคราะห์เป็น 2 โดเมนคือ
- โดเมนทางไฟฟ้า (electrical domain) เช่น ศักย์ไฟฟ้า กระแสไฟฟ้า ประจุไฟฟ้า หรือความต้านทานไฟฟ้า ซึ่งสัญญาณในลักษณะนี้สามารถใช้วงจรอิเล็กทรอนิกส์วัดค่าหรือดำเนินการเก็บข้อมูลได้โดยตรง
- โดเมนที่ไม่ใช่ทางไฟฟ้า (non-electrical domain) เช่น ความร้อน ความเข้มแสง พลังงาน ซึ่งสัญญาณในลักษณะนี้ต้องอาศัยตัวแปลงสัญญาณ (transducer) เพื่อแปลงสัญญาณจากโดเมนที่ไม่ใช่ทางไฟฟ้าให้อยู่ในโดเมนไฟฟ้า
การวิเคราะห์ด้วยเครื่องมือในทางวิเคราะห์ทางเคมีมีหลายเทคนิคด้วยกัน แต่โดยหลักที่เหมือนกันคือตัวตรวจวัด (detectable unit, detector) จะทำการวัดสัญญาณตอบสนองหรือสัญญาณการเปลี่ยนแปลงตามแต่ละเทคนิคที่เกิดจากปริมาณสารที่สนใจวิเคราะห์ (analyte) ในสารตัวอย่าง แล้วจึงแสดงผลลัพธ์ (readout) โดยอาศัยส่วนประมวลสัญญาณ (signal processing) ทำหน้าที่แปลงสัญญาณ บันทึก คำนวณ แปรผล และดำเนินการอื่น ๆ เกี่ยวกับสัญญาณตอบสนอง อย่างไรก็ตาม สัญญาณตอบสนองที่วัดได้จากเครื่องมือวิเคราะห์ จะเป็นสัญญาณที่ไม่อาจเชื่อได้ว่าเป็นความสัมพันธ์เชิงปริมาณที่แท้จริงระหว่างค่าที่เครื่องมือแสดงกับปริมาณของสารที่สนใจวิเคราะห์ ดังนั้นจึงจำเป็นต้องทำการเทียบกับสารมาตรฐาน (standard reagent)
กราฟมาตรฐาน
กราฟมาตรฐาน (calibration curve) หรือกราฟมาตรฐานความเข้มข้น (concentration calibration curve) จัดเป็นการเทียบสารมาตรฐานทางอ้อม ซึ่งกราฟที่สร้างขึ้นเป็นความสัมพันธ์ระหว่างสัญญาณตอบสนองที่วัดได้ (แกน y) กับความเข้มข้นของสารที่สนใจวิเคราะห์ (analyte) ที่เตรียมเป็นสารมาตรฐาน (แกน x) โดยสัญญาณตอบสนองที่วัดได้ต้องแปรผันโดยตรงกับปริมาณสารที่สนใจวิเคราะห์ การสร้างกราฟมาตรฐานจึงเป็นวิธีการสร้างความสัมพันธ์เชิงเส้นตรงระหว่างความเข้มข้นของสารมาตรฐานที่ทราบความเข้มข้น (หรือปริมาณ) กับสัญญาณตอบสนองที่ได้จากเครื่องมือวิเคราะห์ ซึ่งสามารถสร้างกราฟมาตรฐานหลายวิธีด้วยกัน ดังนี้
1. วิธีสารมาตรฐานภายนอก (External standard)
การสร้างกราฟมาตรฐานภายนอก จะต้องกำหนดช่วงความเข้มข้นให้เหมาะสม โดยควรเป็นช่วงความเข้มข้นที่สัมพันธ์กับสัญญาณที่วัดได้มีความเป็นเส้นตรงมากที่สุด เรียกว่า ช่วงความเป็นเส้นตรง (linearity range) โดยเครื่องมือบางประเภทจะมี cook book ระบุสัญญาณตอบสนองที่ใช้สอบเทียบสภาพไว จึงอาจนำมาเป็นแนวทางในการเตรียมชุดสารละลายมาตรฐานเพื่อสร้างกราฟมาตรฐานได้ ส่วนเครื่องมือที่ไม่มี cook book ผู้วิเคราะห์ต้องทดลองหาช่วงความเข้มข้นจากสัญญาณของเครื่องมือ วิธีการสร้างกราฟมาตรฐานภายนอกมีขั้นตอนดังนี้
1.1) เตรียมสารละลายมาตรฐานที่มี analyte ในความเข้มข้นแตกต่างกัน 4-5 ความเข้มข้น และ แบลงค์ (blank) โดยอาจใช้ reagent blank ซึ่งเตรียมตามกระบวนการเดียวกับสารละลายมาตรฐานเพียงแต่ไม่มี analyte เป็นองค์ประกอบ หรืออาจใช้ตัวทำละลายเป็นแบลงค์
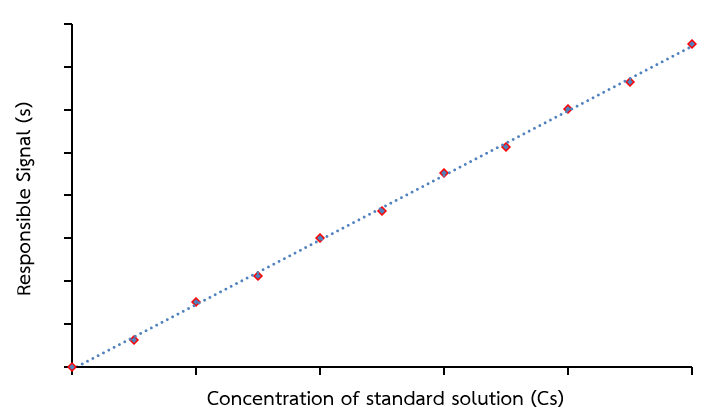
1.2) ทำการปรับศูนย์ด้วยแบลงค์และวิเคราะห์สารละลายมาตรฐานด้วยเครื่องมือ นำสัญญาณตอบสนองมาเขียนกราฟแสดงความสัมพันธ์ระหว่างสัญญาณ (แกน y) กับความเข้มข้นของ analyte (แกน x) และหาสมการเส้นตรงของกราฟ ลักษณะกราฟมาตรฐานแสดงดังภาพที่ 1
1.3) เตรียมสารละลายตัวอย่างเช่นเดียวกับกระบวนเดียวกับการเตรียมสารละลายมาตรฐาน โดยอาจต้องทำละลาย ย่อย หรือเจือจางสารตัวอย่างก่อนเตรียมสารละลายตัวอย่าง
1.4) วิเคราะห์สารละลายตัวอย่าง แทนค่าผลลัพธ์หรือสัญญาณที่ได้ในสมการเส้นตรงเพื่อคำนวณเป็นความเข้มข้นของสารละลายตัวอย่าง แล้วคำนวณกลับเป็นความเข้มข้นของตัวถูกละลายในสารตัวอย่างจริง
ภาพที่ 1 ลักษณะกราฟมาตรฐานความเข้มข้น
เมื่อทำการวิเคราะห์สารตัวอย่าง ความเข้มข้นของสารตัวอย่างที่วิเคราะห์ควรอยู่ในช่วงความเป็นเส้นตรงของกราฟมาตรฐาน โดยสัญญาณที่วัดได้ต้องไม่ต่ำกว่าสัญญาณที่วัดได้ของความเข้มข้นของสารมาตรฐานตัวที่มีความเข้มข้นน้อยที่สุด ในกรณีที่สารตัวอย่างมีสัญญาณต่ำกว่า อาจต้องทำการเพิ่มความเข้มข้น (pre-concentration) ก่อน แต่ถ้าสัญญาณสูงกว่าสัญญาณที่วัดได้ของความเข้มข้นของสารมาตรฐานตัวที่สูงที่สุด จะต้องทำการเจือจาง (dilution) ให้ความเข้มข้นอยู่ในช่วงความเป็นเส้นตรง
วิธี external standard นิยมใช้กันมากที่สุดในการวิเคราะห์เชิงปริมาณ เนื่องจากทำได้ง่าย โดยใช้สารละลายมาตรฐานเพียงชุดเดียว จึงเหมาะสำหรับงานวิเคราะห์ประจำ (routine analysis) ที่วิเคราะห์สารตัวอย่างจำนวนมาก อย่างไรก็ตาม วิธี external standard ก็มีข้อจำกัดที่ก่อให้เกิดความคลาดเคลื่อนเชิงระบบ เนื่องจากเมทริกซ์ของสารละลายตัวอย่างจะไม่เหมือนกับเมทริกซ์ของสารละลายมาตรฐานและแบลงค์ (blank) ได้ทั้งหมดทุกส่วน และการเตรียมสารละลายตัวอย่างจากตัวอย่างจริงเพื่อให้เมทริกซ์ใกล้เคียงกับสารละลายมาตรฐานที่สุดอาจทำให้เกิดการปนเปื้อน (contaminate) หรือสูญเสียสารที่สนใจวิเคราะห์จากสารตัวอย่าง
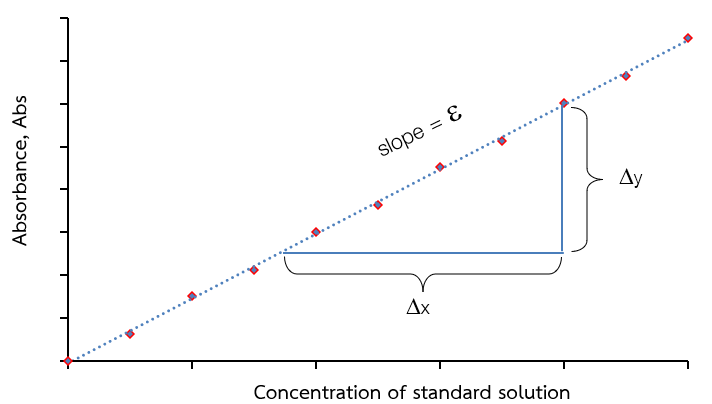
ในที่นี้ขอยกตัวอย่างกราฟมาตรฐานของเทคนิคการวัดการดูดกลืนแสง จากกฎของเบียร์ “ค่าการดูดกลืนแสง (absorbance) เป็นสัดส่วนโดยตรงกับความเข้มข้นของสารที่สนใจที่สามารถดูดกลืนแสงได้ (absorbing analyte species)” ดังนั้นเมื่อนำความสัมพันธ์ระหว่างความเข้มข้นของสารที่สนใจและค่าการดูดกลืนแสงมาสร้างกราฟ จะได้ความสัมพันธ์เชิงเส้นตรง เรียกว่า กราฟมาตรฐานความเข้มข้น (calibration curve) เมื่อค่าการดูดกลืนแสง (absorbance, A) เป็นแกน y และความเข้มข้น (concentration, C) เป็นแกน y จะได้กราฟเส้นตรงที่มีค่าความชันเท่ากับ εb และเมื่อ b เท่ากับ 1 ความชันจึงเท่ากับ ε ดังแสดงในภาพที่ 2
ภาพที่ 2 กราฟมาตรฐานความเข้มข้น (concentration calibration curve)
จุดประสงค์ที่สำคัญของการทำกราฟมาตรฐานความเข้มข้นเพื่อให้ได้สัญญาณการดูดกลืนแสงจากเครื่องมือวัดในขณะนั้น เมื่อใช้ความเข้มข้นของสารมาตรฐาน (external standard solution) ที่ความเข้มข้นต่างกันตามลำดับ (concentration series) สัญญาณการดูดกลืนแสงที่ได้จะเป็นสัดส่วนโดยตรงกับความเข้มข้นตามกฎของเบียร์ และที่สำคัญกราฟความเข้มข้นมาตรฐานจะเป็นเครื่องมือในการหาความเข้มข้นของสารที่สนใจในสารตัวอย่าง โดยอาศัยสมการเส้นตรงของกราฟความเข้มข้นมาตรฐาน
วิธีการสร้างกราฟมาตรฐานความเข้มข้น ทำได้โดยนำสารละลายมาตรฐาน (standard solution) ที่ทราบค่าความเข้มข้นที่แน่นอนอย่างน้อย 4-5 ความเข้มข้น มาวัดค่าการดูดกลืนแสง จากนั้นนำค่าการดูดกลืนแสงที่ได้ของแต่ละความเข้มข้นได้เขียนกราฟระหว่างความเข้มข้นกับค่าการดูดกลืนแสง จะได้กราฟความเข้มข้นมาตรฐาน ส่วนสารตัวอย่างเราไม่ทราบความเข้มข้นของสารที่สนใจ เมื่อนำไปวัดค่าการดูดกลืนแสงที่ความยาวคลื่นเดียวกับวิธีการทำกราฟความเข้มข้นมาตรฐาน เครื่องมือจะรายงานค่าการดูดกลืนแสงของสารตัวอย่าง จากนั้นนำค่าการดูดกลืนแสงของสารตัวอย่างไปหาความเข้มข้นของสารตัวอย่างโดยอาศัยสมการเส้นตรง เราจะทราบค่าความเข้มข้นของสารที่สนใจในสารตัวอย่างได้
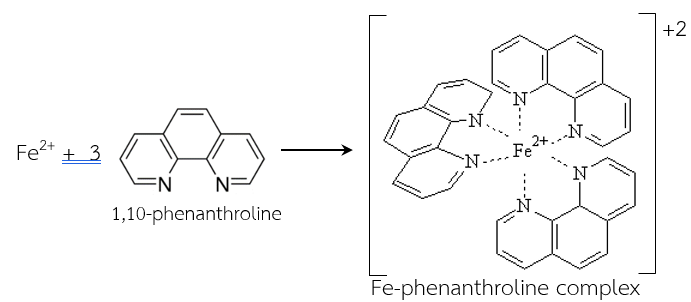
ตัวอย่างการวิเคราะห์ปริมาณเหล็กด้วยวิธีวัดค่าการดูดกลืนแสง ทำได้โดยให้เกิดไอออนเชิงซ้อนที่มีสี (สีแดงถึงส้ม) ระหว่าง Fe2+ กับ 1,10-phenanthroline ที่เรียกว่าไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน (Fe-Phen) ซึ่งดูดกลืนแสงที่ความยาวคลื่น 510 nm โดยควบคุม pH ด้วยสารละลายบัพเฟอร์ประมาณ pH 3.5 เพื่อป้องกันไม่ให้เกิดตะกอนเป็น Fe(OH)2 และจะต้องเติมตัวรีดิวซ์เพื่อทำการรีดิวซ์เหล็กทั้งหมดในสารละลายให้เป็น Fe2+ เสียก่อนโดยใช้สารละลายไฮดรอกซีลามีนไฮโดรคลอไรด์ (hydroxylamine hydrochloride) สีของไอออนเชิงซ้อนระหว่างเหล็ก(II) กับฟีแนนโทรลีนจะเสถียรได้นาน (วรวิทย์ จันทร์สุวรรณ, 2563)
4Fe3++ 2NH2OH → 4Fe2++ N2O + 4H+ + H2O
Fe2+(aq) + 3PhH+ → Fe(Ph)32+ + 3H+
ภาพที่ 3 ไอออนเชิงซ้อนระหว่างเหล็ก(II) กับฟีแนนโทรลีน
การเตรียมกราฟมาตรฐานความเข้มข้นทำได้โดย เตรียมสารละลายเหล็กมาตรฐานให้มีความเข้มข้นแตกต่างกันเป็นลำดับจำนวน 6 ความเข้มข้นในขวดวัดปริมาตร (ในการเตรียมชุดสารละลายมาตรฐานจะต้องไม่มีความคลาดเคลื่อนเกี่ยวกับการเตรียม เช่นปริมาตรที่ปิเปตและการปรับปริมาตรสุดท้าย) ความเข้มข้นของเหล็กที่เตรียมดังตารางที่ 1
ตารางที่ 1 ความเข้มข้นของเหล็ก(II) สำหรับทำกราฟมาตรฐานความเข้มข้น
| ขวดที่ | ความเข้มข้น (mg/L) |
| 1 | 0.20 |
| 2 | 0.40 |
| 3 | 0.60 |
| 4 | 0.80 |
| 5 | 1.00 |
| 6 | 1.20 |
จากนั้นเติมสารละลาย NH2OH×HCl และแอซิเตตบัฟเฟอร์ (acetate buffer) อย่างละ 1 mL ลงไป แล้วเติม 1,10-phenanthrolien ปริมาตร 2 mL แล้วเติมน้ำกลั่นลงใปจนครบขีดปริมาตร (ขวดวัดปริมาตร 50 mL) เขย่าให้เข้ากันแล้วตั้งทิ้งไว้ 10 นาที จะได้สารละลายสีส้มแดงของไอออนเชิงซ้อนดังภาพที่ 4 จากนั้นนำสารละลายแต่ละขวดไปวัดค่าการดูดกลืนแสงที่ 517 nm ได้ผลดังตารางที่ 2
 ภาพที่ 4 สีของไอออนเชิงซ้อนเหล็ก-ฟีแนนโทรลีน
ภาพที่ 4 สีของไอออนเชิงซ้อนเหล็ก-ฟีแนนโทรลีน
ตารางที่ 2 ค่าการดูดกลืนแสงของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน
| ขวดที่ | ความเข้มข้น (mg/L) | Abs ที่ 517 nm |
| 1 | 0.20 | 0.115 |
| 2 | 0.40 | 0.160 |
| 3 | 0.60 | 0.210 |
| 4 | 0.80 | 0.285 |
| 5 | 1.00 | 0.355 |
| 6 | 1.20 | 0.420 |
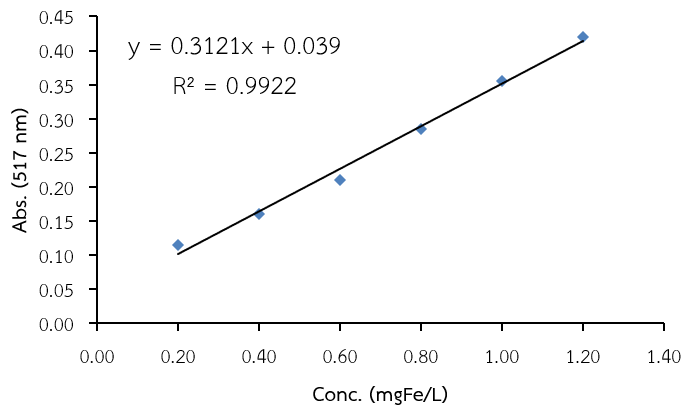
จากนั้นนำค่าการดูดกลืนแสงของแต่ละความเข้มข้นมาเขียนกราฟระหว่างความเข้มข้นของเหล็กกับค่าการดูดกลืนแสงของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน จะได้กราฟเส้นตรงดังภาพที่ 5 (วรวิทย์ จันทร์สุวรรณ, 2563)
 ภาพที่ 5 กราฟมาตรฐานความเข้มข้นของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน.
ภาพที่ 5 กราฟมาตรฐานความเข้มข้นของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน.
กราฟมาตรฐานที่สร้างโดยใช้โปรแกรม MS excel จะได้ข้อมูลเกี่ยวกับสมการเส้นตรงที่บอกค่าความชัน (slope) และจุดตัดแกน y (intercept-y) และยังสามารถบอกความเป็นเส้นตรงว่ากราฟนั้นมีความเป็นเส้นตรงมากน้อยเพียงใด ถ้าค่า R2 ใกล้ 1 แสดงว่ากราฟนั้นมีความเป็นเส้นตรงสูง โดยทั่วไปในการวิเคราะห์เชิงปริมาณค่า R2 ต้องมากกว่า 0.99 ซึ่งจากกราฟเส้นตรงของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน พบว่า ค่าความชัน = 0.3121 จุดตัดแกน y = 0.039 และ R2 = 0.9925
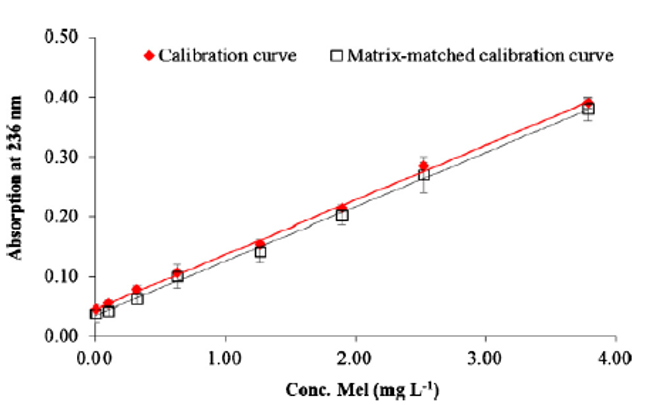
แต่ในกรณีที่ตัวอย่างอาจสิ่งรบกวน (matrix) หรือสิ่งเจือปนที่ทำให้องค์ประกอบส่วนใหญ่นั้นแตกต่างจากสารมาตรฐาน และสิ่งรบกวนเหล่านั้นอาจมีผลต่อการดูดกลืนแสงทั้งบวกหรือทางลบ เราสามารถทำการเติมสารมาตรฐานแล้วทำการวัดค่าการดูดกลืนแสง เรียกว่าวิธี matrix-matched calibration โดยวิธีนี้สามารถบ่งชี้ถึงผลของสิ่งรบกวนโดยดูจากกราฟเส้นตรง โดยถ้ากราฟระหว่างกราฟมาตรฐานความเข้มข้นกับ matrix-matched calibration มีความชันเท่ากันหรือใกล้เคียงกัน เส้นกราฟจะขนานกัน อธิบายได้ว่าผลของสิ่งรบกวนในสารตัวอย่างไม่มีผลต่อการวิเคราะห์ เช่นการพัฒนาวิธีการวิเคราะห์เมลามีนในนมผง (Chansuvarn et al., 2013) ดังภาพที่ 6 แต่ถ้าความชันไม่เท่ากันหรือไม่ใกล้เคียงกัน เส้นกราฟจะไม่ขนานกัน (Silva, et al., 2017) ดังภาพที่ 7 อธิบายได้ว่าสิ่งรบกวนหรือสารเจือปนในสารตัวอย่างมีผลต่อการวิเคราะห์อย่างมีนัยสำคัญ
ภาพที่ 6 ผลการทำ matrix-matched calibration. ที่มาจาก Chansuvarn, Panich, & Imyim, Spectrochimica Acta Part A. 113 (2013) 154-158.
ภาพที่ 7 ผลการทำ matrix-matched calibration. ที่มาจาก Silva et. al, Poultry Science. 96 (2017) 3375-3381.
วิธีเติมสารมาตรฐาน (Standard addition)
วิธีเติมสารมาตรฐาน (Standard addition) หรือเรียกอีกอย่างว่า spiked method เป็นอีกวิธีที่นิยมใช้ในการวิเคราะห์เชิงปริมาณของสารที่สนใจที่มีสารที่มีเมทริกซ์เจือปนมาก (matrix effect) ซึ่งอาจจะมีผลต่อการวิเคราะห์ได้ และไม่อาจใช้วิธี matrix-matched calibration ได้ โดยหลักการของวิธีนี้คือการเติมสารละลายมาตรฐานที่ทราบความเข้มข้นที่แน่นอนลงในสารตัวอย่างจะทำการวิเคราะห์สารที่สนใจ โดยขั้นตอนวิธีเติมสารละลาย ทำได้ดังนี้
- เตรียมสารละลายตัวอย่างที่ไม่ทราบความเข้มข้น (Cx) ปริมาตรแน่นอน (Vx) เท่ากัน ในขวดวัดปริมาตรอย่างน้อย 5-6 ขวด
- เติมสารละลายมาตรฐานที่ทราบความเข้มข้น (Cs) ปริมาตรที่แตกต่างกันเป็นลำดับ (Vs)
- เติมสารอื่นๆ ที่เกี่ยวข้องในปฏิกิริยา ให้เท่ากันทุกๆ ขวด และปรับปริมาตรด้วยตัวทำละลาย (ปริมาตรรวม Vt)
- ทำการปรับศูนย์ด้วยแบลงค์และวิเคราะห์สารละลายมาตรฐานที่เติมสารตัวอย่าง (spiked sample) ด้วยเครื่องมือ ได้สัญญาณตอบสนองเป็น S นำสัญญาณตอบสนอง (S)
ภาพที่ 8 วิธีเติมสารมาตรฐาน (Standard addition)
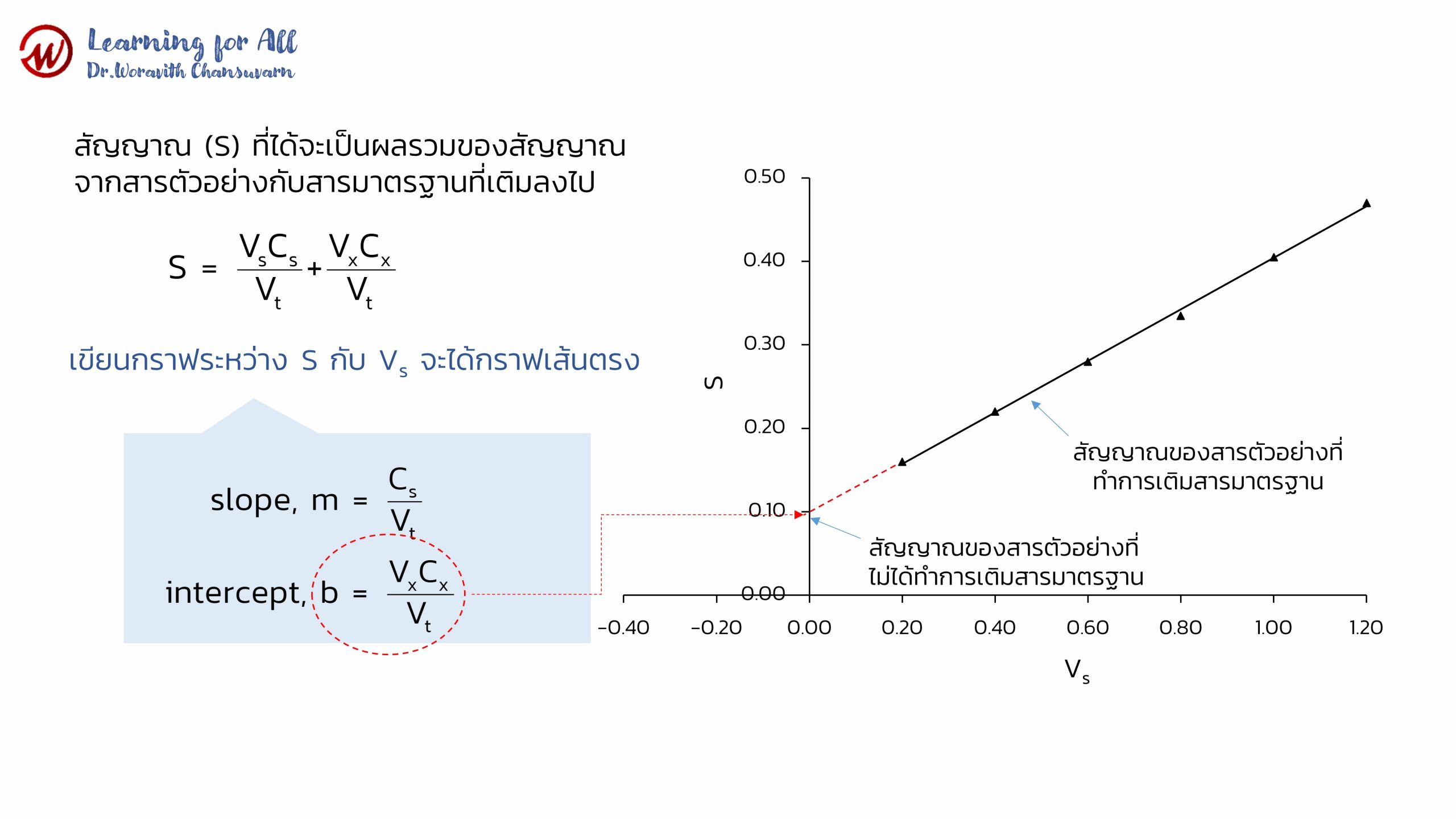
สัญญาณตอบสนอง (S) ที่ได้จะเป็นผลรวมของสัญญาณจากสารตัวอย่างกับสารมาตรฐานที่เติมลงไป ดังนี้
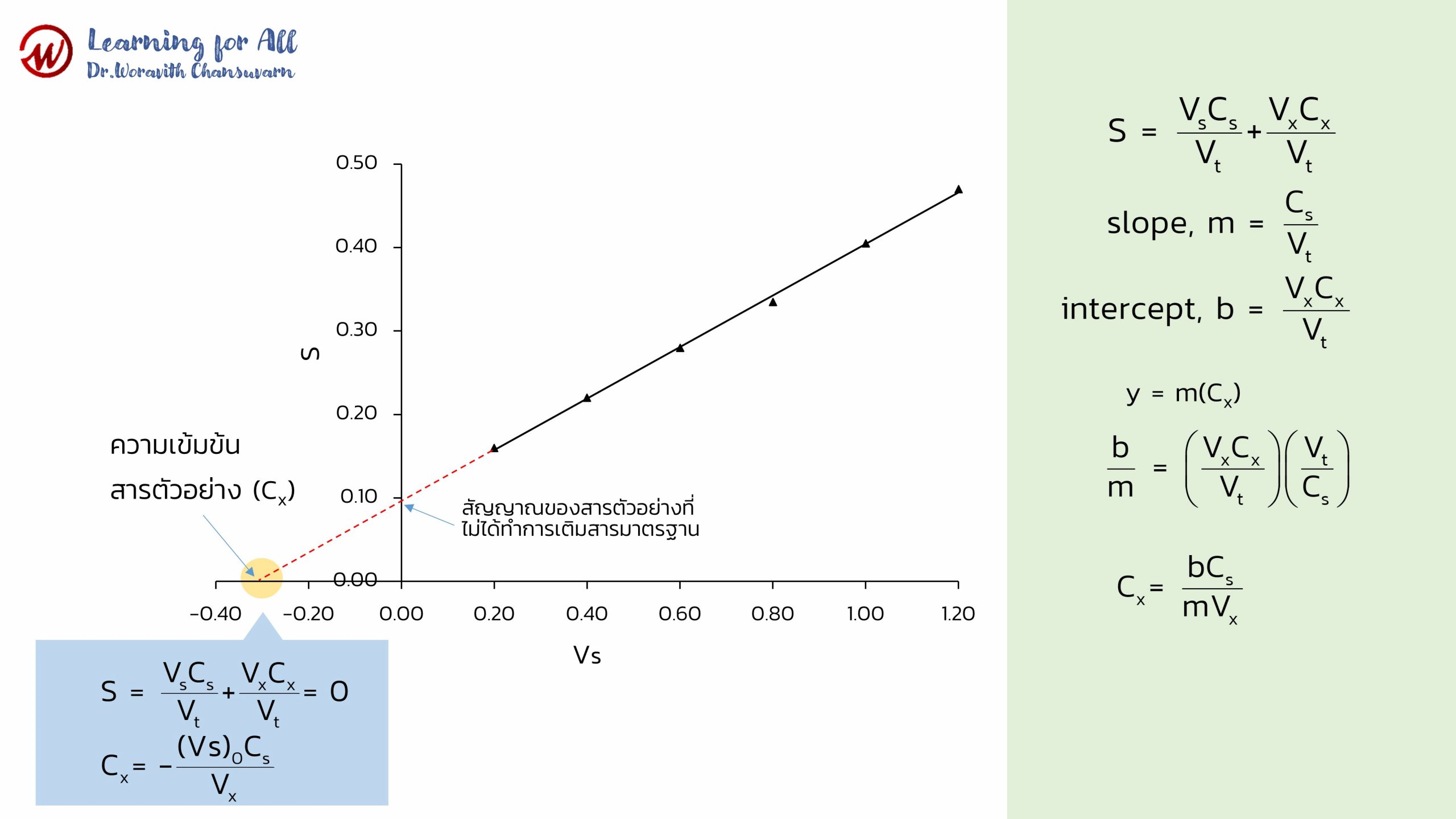
เมื่อเขียนกราฟระหว่าง S กับ Vs จะได้กราฟเส้นตรง ดังภาพที่ 9 โดยที่ slope (m) = Cs/Vt และจุดตัดแกน (b) =VxCx/Vt
สารตัวอย่างที่ไม่ทราบความเข้มข้น (Cx) สามารถหาความเข้มข้น ได้ดังนี้
ภาพที่ 9 กราฟมาตรฐานของวิธีการเติมสารมาตรฐาน
จากกราฟภาพที่ 9 เมื่อลากเส้นต่อจากเส้นตรงไปตัดแกน y ที่จุดตัดแกน y จะเป็นสัญญาณของสารตัวอย่างที่ไม่ได้ทำการเติมสารมาตรฐาน (Sx) และที่จุดตัดแกน x จะเป็นความเข้มข้นของสารที่สนใจในสารตัวอย่าง (Cx) ดังนั้น เมื่อสัญญาณรวมเป็นศูนย์ เราสามารถคำนวณความเข้มข้นของสารตัวอย่างได้ดังสมการ
ข้อดีวิธี standard addition คือสามารถลดผลจากเมทริกซ์และตัวรบกวนที่อาจส่งผลกระทบต่อการวิเคราะห์ เนื่องจากในสารละลายมาตรฐานแต่ละขวดที่ใช้เตรียมสำหรับสร้างกราฟมาตรฐานนั้นจะมีผลของเมทริกซ์ของสารตัวอย่างที่เติม (spike) ลงไปอยู่ในปริมาณที่ใกล้เคียงกันมาก จึงทำให้ผลการวิเคราะห์มีความถูกต้องและน่าเชื่อถือมากขึ้น แต่ก็มีข้อจำกัดเช่นกันคือความเข้มข้นของสารตัวอย่างที่เติม (spike) ลงไปต้องอยู่ในช่วงความเป็นเส้นตรงในช่วงใช้งาน (linear working range) และสปีชีส์ของสารตัวอย่างที่เติม (spike) และสารที่สนใจต้องเหมือนกัน (Fortunato, et al., 2015) นอกจากนี้สารละลายมาตรฐานหนึ่งชุดที่ใช้สร้างกราฟมาตรฐานจะใช้วิเคราะห์สารตัวอย่างได้เพียงตัวอย่างเดียว จึงทำให้สิ้นเปลืองสารเคมีและเวลาอย่างมาก แต่ในบางกรณีที่ไม่ต้องการความถูกต้องมากนัก อาจใช้วิธีการเติมแบบสารเดี่ยว (single addition) ในการวิเคราะห์ ซึ่งทำได้ง่ายกว่าและประหยัดทั้งเวลาและสารเคมีมากกว่า โดยวิเคราะห์สารละลายตัวอย่าง ได้สัญญาณ S1 จากนั้นเติมสารละลายมาตรฐานลงในสารตัวอย่าง แล้ววิเคราะห์อีกครั้งหนึ่ง ได้สัญญาณ S2 นำผลที่ได้จากทั้งสองครั้งมาคำนวณหาความเข้มข้นของสารที่สนใจวิเคราะห์ในสารตัวอย่าง
วิธีสารมาตรฐานภายใน (Internal standard)
สารมาตรฐานภายใน (internal standard) คือสารที่ถูกเติมในสารมาตรฐานการสอบเทียบ แบลงค์และสารตัวอย่างทุกตัวในปริมาณที่เท่า ๆ กัน โดยสารมาตรฐานภายในต้องเป็นสารคนละชนิดกับสารที่สนใจวิเคราะห์ โดยต้องพิจารณาคุณสมบัติของสารที่จะใช้เป็น สารละลายมาตรฐานภายใน ดังนี้
- ต้องไม่เป็นองค์ประกอบหรือมีอยู่ในสารตัวอย่าง
- ต้องแยกออกจากตัวอย่างได้อย่างสมบูรณ์
- ต้องไม่ทำปฏิกิริยากับสารที่มีอยู่ในตัวอย่าง
- ต้องมีความบริสุทธิ์สูง
- เมื่อนำมาใช้ต้องมีปริมาณใกล้เคียงกับสารตัวอย่างที่ต้องการหา
- สารที่ใช้เป็นสารละลายมาตรฐานภายในต้องมีความสัมพันธ์เชิงเส้นตรง ในช่วงความเข้มข้นที่ต้องการวิเคราะห์
วิธีพื้นฐานสำหรับการทำวิธีสารละลายมาตรฐานภายใน มีขั้นตอนดังนี้
1) เตรียมสารละลายมาตรฐานที่มีสารที่สนใจวิเคราะห์ซึ่งทราบความเข้มข้นหลายความเข้มข้นและแบลงค์ ก่อนปรับปริมาตรด้วยตัวทำละลายให้เติมสารมาตรฐานภายในความเข้มข้นเท่ากันในทุกขวด
2) วิเคราะห์แบลงค์และสารละลายมาตรฐาน จากนั้นเขียนกราฟโดยให้แกน x เป็นความเข้มข้นของสารที่สนใจวิเคราะห์ และแกน y เป็นอัตราส่วนระหว่างสัญญาณของสารที่สนใจวิเคราะห์ต่อสัญญาณของสารมาตรฐานภายในและหาสมการเส้นตรง
3) เตรียมสารละลายตัวอย่างด้วยกระบวนเดียวกับการเตรียมสารละลายมาตรฐาน และเติมสารมาตรฐานภายใน ความเข้มข้นเท่ากับที่เติมในสารละลายมาตรฐาน
4) วิเคราะห์สารละลายตัวอย่าง หาอัตราส่วนของสัญญาณของสารที่สนใจวิเคราะห์ต่อสัญญาณของ สารมาตรฐานภายใน แล้วแทนค่าในสมการเส้นตรงเพื่อคำนวณเป็นความเข้มข้นของสารละลายตัวอย่าง แล้วแปลงกลับเป็นความเข้มข้นของสารที่สนใจวิเคราะห์ในตัวอย่าง
การวิเคราะห์แบบสารมาตรฐานภายใน ต้องเติมสารที่เลือกใช้ เป็นสารมาตรฐานลงไปทั้งในตัวอย่างและสารมาตรฐานด้วยความเข้มที่เท่ากัน ดังนั้นเมื่อนำสัญญาณที่วัดได้มาเขียนกราฟจะเป็นการเปรียบเทียบเป็นสัดส่วน (ratio) ระหว่างสัญญาณของสารมาตรฐานต่อสารมาตรฐานภายใน ดังนั้นถ้าสัญญาณของสารที่สนใจทดสอบลดลง สัญญาณของสารมาตรฐานภายในก็จะลดลงไปด้วย ดังนั้น สัญญาณของสารมาตรฐานภายในเป็นตัวเปรียบเทียบ ช่วยลดควบคุมความผิดพลาดที่เกิดขึ้น ลักษณะกราฟมาตรฐานเป็นสัดส่วนสัญญาณ (แกน x) และสัดส่วนปริมาณสารที่สนใจ (แกน y) ระหว่างสารมาตรฐานต่อสารมาตรฐานภายใน ภาพที่ 11

ภาพที่ 10 โครมาโทรแกรมของสารมาตรฐานภายใน
ภาพที่ 11 กราฟมาตรฐานของวิธีสารมาตรฐานภายใน
การเลือกใช้สารมาตรฐานภายในที่เหมาะสมสามารถแก้ไขทั้งความคลาดเคลื่อนแบบสุ่มและเชิงระบบ เมื่อสารมาตรฐานภายในเป็นองค์ประกอบหลักของตัวอย่างและสารมาตรฐานสามารถใช้เพื่อแก้ไขความคลาดเคลื่อนด้านต่าง ๆ ที่มาจากการเตรียมตัวอย่าง สารละลาย และการทำความสะอาด (cleanup) ข้อดีของวิธีสารมาตรฐานภายใน คือสามารถลดความคลาดเคลื่อนจาก instrumental drift และผลของเมทริกซ์ได้ หากสารที่สนใจวิเคราะห์กับสารมาตรฐานภายในตอบสนองต่อเครื่องมือหรือเมทริกซ์ในทิศทางเดียวกัน เพราะการ drift ดังกล่าว แม้จะทำให้การตอบสนองเปลี่ยนไป แต่อัตราส่วนของสัญญาณระหว่างสารที่สนใจวิเคราะห์กับสารมาตรฐานภายใน จะยังคงมีค่าเท่าเดิม ส่วนข้อจำกัดคือการหาสารมาตรฐานภายในที่เหมาะสมนั้นทำได้ยาก เพราะจะต้องไม่มีในสารตัวอย่าง และต้องตอบสนองต่อเครื่องมือและวิธีวิเคราะห์คล้ายคลึงกับสารที่สนใจวิเคราะห์ที่เราพิจารณา และไม่รบกวนหรือถูกรบกวนจากสารที่สนใจวิเคราะห์
โดยส่วนใหญ่วิธีสารมาตรฐานภายในนิยมใช้กับวิธีวิเคราะห์เทคนิคการแยก (separation analytical methods) เช่น GC และ HPLC มากกว่าทางเทคนิคสเปกโทรสโกปี อย่างไรก็ตามสารที่เป็น internal standard ควรต้องมีสมบัติคล้ายกับสารที่สนใจวิเคราะห์ ไม่ทำปฏิกิริยากับสารอื่น ๆ ที่เกี่ยวข้อง และต้องสารนั้นต้องมีความบริสุทธิ์
วิธี Standard dilution analysis
วิธี standard dilution analysis (Jones, et al., 2015) เป็นวิธีสร้างกราฟมาตรฐานแบบใหม่โดยเป็นการรวมหลักการของวิธี standard addition และวิธี internal standard เข้าด้วยกัน ซึ่งจะมีข้อเด่นในการขจัดปัญหารบกวนจากผลของเมทริกซ์และความคลาดเคลื่อนจาก instrumental drift ได้ในขณะเดียวกัน ทั้งนี้ยังไม่จำเป็นต้องเตรียมชุดความเข้มข้นสารละลายมาตรฐานและการสร้างกราฟมาตรฐานแบบภายนอกอีก ในขั้นการทดลองโดยเป็นการรวมสารละลายสองชนิดในขวดเดียว โดยสารที่สนใจ (A) ในสารตัวอย่าง ถูกนำมาผสมรวมกับสารละลายผสมระหว่างสารละลายมาตรฐานและสปีชีส์ของ internal standard (I)
สัญญาณสารที่สนใจในสารตัวอย่าง (SA) ได้มาจากสัญญาณของสารตัวอย่าง (sam) และสัญญาณของสารมาตรฐาน (std) ที่ถูกวัดที่ความยาวคลื่นหนึ่ง ส่วนสัญญาณของ internal standard จะได้จากสาร internal standard เท่านั้น ดังนั้นสัญญาณสารที่สนใจในสารตัวอย่าง (SA) จึงเป็นผลคูณระหว่างสภาพไว (calibration sensitivity, mA) และความเข้มข้น (CA)
SA = mACA
เมื่อ mA คือ calibration sensitivity ของสารที่สนใจ และ CA คือ ความเข้มข้นของสารที่สนใจ
ในทำนองเดียวกัน สัญญาณของสาร internal standard (SI)
SI = mICI
เมื่อ mI คือ calibration sensitivity ของสาร internal standard และ CI คือ ความเข้มข้นของสาร internal standard
อัตราส่วนระหว่างสัญญาณสารที่สนใจในสารตัวอย่าง (SA) กับสัญญาณของสาร internal standard (SI) เป็นดังนี้
...อยู่ระหว่างปรับปรุงเพิมเติม.....
เอกสารอ้างอิง
- วรวิทย์ จันทร์สุวรรณ. (2565). เคมีวิเคราะห์: หลักการและเทคนิคการคำนวณเชิงปริมาณ (พิมพ์ครั้งที่ 2). สำนักพิมพ์จุฬาลงกรณ์มหาวิทยาลัย.
- Chansuvarn, W., Panich, S., & Imyim, A. (2013). Simple spectrophotometric method for determination of melamine in liquid milks based on green Mannich reaction. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 113. 154-158.
- Fortunato, F.M., Bechlin, M.A., Neto, J.A.N., Donati, G.L., & Jones, B.T. (2015). Internal standard addition calibration: Determination of calcium and magnesium by atomic absorption spectrometry, Microchemical J., 122, 63-69.
- Jones, W.B., Donati, G.L., Calloway, C.P., & Jones, B.T. (2015). Standard Dilution Analysis. Anal. Chem., 87(4), 2321–2327.
- Silva, G.R., Menezes, L.D.M., Lanza, I.P., Oliveira, D.D., Silva, C.A., Klein, R.W.T., Assis, D.C.S., & Cançado S.V. (2017). Evaluation of the alpha-amylase activity as an indicator of pasteurization efficiency and microbiological quality of liquid whole eggs. Poultry Science, 96(9), 3375–3381.
- Skoog, D.A., Holle,r F.J., & Crouch, S.R. (2007). Principles of Instrumental Analysis, 6th ed. Thomson Brooks/Cole.
Download >> [Calibration method] [PPT]